SARS CoV-2表面上的棒状刺突蛋白是COVID-19大流行病的矛尖。尖峰通过ACE2受体与人体细胞结合,然后急剧改变形状,顶起刀形以将细胞膜与冠状病毒的外膜融合在一起,并打开了感染冠状病毒的大门。由波士顿儿童医院领导的一项研究首次冻结了刺突蛋白的“前”和“后”形状。
这项研究于7月21日在《科学》杂志上发表,它还捕获了刺突蛋白的一些令人惊讶的特征,该突触蛋白也是我们抗体靶向的主要蛋白,也是目前人类测试中用于大多数疫苗的蛋白。由陈冰博士领导的研究人员认为,这些意外的功能可能有助于SARS-CoV-2躲避免疫系统并在环境中生存更长的时间。它们也可能对疫苗和治疗发展产生影响。
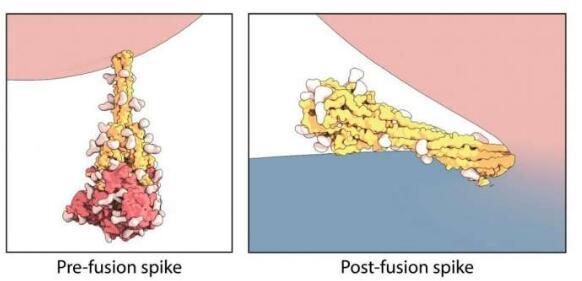
使用低温电子显微镜技术,波士顿儿童分子医学部的Chen和同事在病毒和细胞膜融合之前和之后建立了刺突蛋白的结构。他们发现,在“融合后”的状态下,蛋白质呈现出折叠成自身的刚性发夹状。
有趣的是,他们还发现刺突蛋白有时会过早地从其原始的“前”形变为“后”形,而病毒不会与ACE2受体结合。
“我们建议构象改变有两条途径,” Chen说。“一个是ACE2依赖性的,它允许病毒进入宿主细胞。第二个是ACE2依赖性的。”
冠状病毒的防御机制?
由于自发形状的改变,冠状病毒颗粒经常带有两种形式的刺突蛋白,而刚性的“后”形则从病毒表面突出更多。Chen建议即使在不与细胞结合的情况下也能够呈现这种替代形状,可能有助于使SARS-CoV-2在环境中保持活力,从而防止SARS-CoV-2降落在表面上时分解。这可以解释为什么病毒似乎可以在各种表面上存活数小时至数天。
Chen说:“大多数病毒不能在宿主体内存活很长时间。”“我们认为这些融合后尖峰的刚性结构可以保护病毒。”
逃避免疫检测
研究人员推测,有些峰值假定融合后形式过早也可能会保护SARS-CoV-2免受我们的免疫系统的影响,诱导出非中和且无法有效遏制该病毒的抗体。实际上,融合后的峰值可能充当诱骗免疫系统的诱饵。
该团队还惊讶地发现,与融合前的峰值相似,融合后的峰值在其表面上均匀分布的位置具有聚糖或糖分子。聚糖是帮助病毒避免免疫检测的另一个功能。
陈认为,他的团队的发现对疫苗开发具有重要意义。他指出,目前使用刺突蛋白刺激免疫系统的疫苗制剂可能具有融合前和融合后形式的不同混合,这可能会限制其保护功效。
他说:“我们需要考虑如何稳定刺突蛋白。”“如果蛋白质不稳定,则可以诱导抗体,但在阻断病毒方面效果较差。批次之间可能会有变异。”
利用艾滋病毒的经验
Chen多年来对HIV的研究帮助他的团队在研究SARS-CoV-2方面一臂之力。两种病毒都被称为包膜病毒,需要将其膜与它们试图进入的细胞融合。两者都使用相同的千斤顶刀形状变化,并且都在其表面上带有糖装饰的刺突蛋白。最后,开发中和抗体的挑战困扰着HIV疫苗的开发,它也分散了免疫系统的注意力,产生了无法关闭病毒的多种抗体。
Chen说:“我认为SARS-CoV-2可能比HIV更容易被感染,但是我们必须要看到。”“如果第一轮疫苗在3期试验中效果不佳,那么这种对突波结构的新认识将有助于我们设计更强大的疫苗。”
 教育新闻网
教育新闻网