马里兰大学医学院(UMSOM)的研究人员已经确定某些基因突变如何导致肌萎缩性侧索硬化症(ALS),也称为Lou Gehrig病。研究人员确定的途径也可能导致某种形式的与ALS相关的痴呆。这一发现可能为治疗这种破坏性疾病提供潜在的新方法,这种疾病会导致进行性,致命性瘫痪,有时甚至类似于阿尔茨海默氏病的精神退化。他们的发现发表在本周的美国国家科学院院刊(PNAS)上,其中包括来自哈佛大学,奥克兰大学,伦敦国王学院和西北大学的合作者。
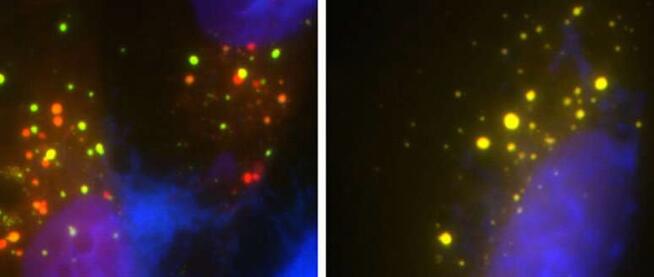
每年有5,000多名美国人被诊断出患有ALS,这种疾病通常是致命的,无法治愈。ALS患者逐渐失去了运动肌肉的能力,导致呼吸和吞咽等基本功能出现问题。大约一半的ALS患者也会发展为痴呆症。对易患ALS的家庭进行的遗传研究表明,该疾病可能与某些基因突变有关。这些突变中的一些涉及基因UBQLN2,该基因调节来自人体细胞的错误折叠的“垃圾”的处置。到目前为止,研究人员尚未完全了解UBQLN2突变如何干扰该途径并引起ALS。
“我们研究了泛蛋白2(UBQLN2)基因突变破坏细胞用来清除垃圾的重要回收途径的过程,”隶属于解剖学和神经生物学的教授Mervyn Monteiro博士说。与UMSOM的UMSOM生物医学工程和技术中心(BioMET)合作。“如果没有这种循环利用,错误折叠的蛋白质会在神经细胞中积聚并变得有毒,最终破坏细胞。这种破坏可能导致神经退行性疾病,例如ALS。”
为了研究UBQLN2突变如何导致ALS,Monteiro博士的小组使用了人类细胞和UBQLN2突变小鼠模型进行了研究。他们在2016年PNAS出版物中描述的小鼠模型模拟了遗传这些基因突变的人的疾病进展。
蒙特罗博士的研究小组首先从人细胞中去除了UBQLN2基因,发现它完全阻碍了回收途径。然后,他们将正常基因或五个基因突变之一重新引入细胞。他们发现正常的UBQLN2的重新引入恢复了回收途径,而所有五个基因突变均未能重启该途径。
Monteiro博士和他的同事使用小鼠模型概述了存在基因突变时途径中断的原因。他们发现具有基因突变的小鼠的某种蛋白质ATP6v1g1的含量降低了,这是泵的重要组成部分,该泵会酸化细胞的垃圾容器,从而启动分解和回收过程。
蒙特罗博士说:“我们的新发现令人兴奋,因为在阿尔茨海默氏症,帕金森氏症和唐氏综合症中也发现了类似的酸化缺陷。”“这表明缺陷的修复不仅对治疗ALS具有广泛的意义,而且对其他神经退行性疾病也可能具有广泛的意义。”
“ Monteiro博士领导的BioMET研究团队在理解引起ALS的机制方面继续取得重要进展,” MBA院长兼医学执行副总裁Dean E. Albert Reece博士说。马里兰大学巴尔的摩分校事务,以及马里兰大学医学院的John Z.和Akiko K. Bowers杰出教授。没有这项基础性的工作,就不可能对这种破坏性疾病进行未来的治疗和预防措施。”
 教育新闻网
教育新闻网